情報通信研究機構(NICT) 未来ICT研究所
神戸フロンティア研究センター 神経網ICT研究室 行動神経生物学プロジェクト(山元研究室)
私たちの研究室では、動物の行動が起こる仕組みを、分子(遺伝子)・細胞(脳)・個体のレ ベルで解明していくことを目指しています。
研究内容
3.分子
すでに述べたように、山元研で分離された複数の突然変異の原因遺伝子クローニングは、おおむね成功した。しかし、その結果姿を現したタンパク質たちが、どのような生化学的機能を介して行動の制御という大役を果たすのか、その多くは秘密のベールに包まれている。もっとも解析が進んでいるのは、ここでもやはりfruitless遺伝子についてである。
Fruitlessタンパク質はN末端にBTBドメイン、C末端にZn fingerモチーフを持つ6,16)ことから、DNAに結合して結合した相手の遺伝子の読み出し(転写)をコントロールする転写調節因子であろうと予想された。が、しょせん予想に過ぎない。本当のところは不明である。なにをやっているのか定かでない遺伝子の機能を探る方法はいくつかあるが、遺伝学が使える生物ならば、問題の遺伝子の働きを強めたり弱めたりする第2の突然変異を見つけるというのが優れた戦法となっている。第2の突然変異の原因遺伝子が、運よく機能の解明されたものであったなら、おのずと新しい(第1の)遺伝子の機能も明らかになるというわけである。fruitlessについてもこの遺伝学的戦法で攻めようということになった。正常型fruitless遺伝子を幼虫期の複眼原基に異所的に発現させると、理由はわからないが複眼形成が異常になり、個眼の減少、配列の乱れ、融合といった現象が惹き起こされる。成虫の複眼を見れば、その異常は一目瞭然である。そこで、この“見やすい”fruitless優性表現型を利用して、複眼の異常を強めたり弱めたりする突然変異を探索したのである。山元研の伊藤弘樹28)は、このfruitless表現型を優性に抑圧する(弱める)ものとして、bonus(bon)の機能喪失アリルを見つけてきた。Bonは哺乳類ではTIF1の名で知られる転写補助因子であり、DNAの折り畳み(クロマチン)を制御するタンパク質のHDAC1 (Histone deacetylase 1)やHP1a (Heterochromatin protein 1a)と複合体を形成して転写をコントロールすることがわかっていた。BonとHDAC1の機能喪失変異アリルを機能低下型fruitless変異体に1コピー持たせると、fruitless変異によって低下した雄の求愛活性がさらに低下する。一方、HP1aの機能喪失変異アリルは逆にfruitless変異によって低下した雄の求愛活性を回復させた。このことから、複眼発生という異所的なシステムを用いて同定されたfruitlessの修飾因子、bonが、性行動というfruitlessの本来の機能に対しても修飾機能を持つことは明らかである。
そこで、Fruitless、Bon、HDAC、HP1aのそれぞれを特異的に認識する抗体に結合するタンパク質を、キイロショウジョウバエの抽出物から取り出して(免疫沈降によって)調べてみた(Western blotting)ところ、どのタンパク質を認識する抗体を用いても、残りの3つのタンパク質が一緒に取れてくる(共沈する)ことが分かった。つまり、Fruitless、Bon、HDAC1、HP1aの4つは体内で(in vivoで)複合体を形成している。ただし、4つ全てが同時に一つの複合体に含まれているとはいえない。むしろ、HDAC1とHP1aは相互排他的な関係にあるようである。さらに、唾腺染色体に4つのタンパク質に対する抗体を作用させ、染色体のどの場所にそれぞれのタンパク質が局在するのかを調べた。すると、Fruitlessタンパク質は染色体上の約100か所に結合しており、Bonはその全てにおいて共存し、HDAC1は84か所、HP1aは20ケ所で共存していた。これらの結果から、染色体の標的部位(ターゲット遺伝子)にFruitlessタンパク質が結合するとその場所にBonが集結し、そのBonは続いてHDAC1又はHP1aを呼び寄せて、クロマチンの開閉が惹き起こされると推察された。クロマチンが開くと遺伝子の転写が可能になり、クロマチンが閉じると転写が抑制される。こうしてfruitless遺伝子は100前後の標的遺伝子の転写をオンオフし、一気に“雄らしい脳”を作り出すものと考えられた。
では、“雄らしい脳”の実体はなんだろうか。すでに紹介したmALニューロンに着目して、HDAC1やHP1aの機能を低下させたときに何が起こるかを調べてみた。まずfruitlessの機能低下変異体を見てみると、mALクラスター全体を丸ごと染色した時には、mALクラスターは雌雄中間の外観を呈した。ところがMARCM法によってニューロンを一個一個染め出してみると、雌雄中間の形をしたものはただの一個もなく、つねに完全な雄型か完全な雌型をしていた。つまり、クラスター全体を見たときに雌雄中間型となっていたのは、雌型ニューロンと雄型ニューロンとが混在していたからということになる。Fruitlessタンパク質の機能が低下するにつれ雄型ニューロンが減って雌型ニューロンが増え、fruitless遺伝子の完全な機能喪失条件(たとえばsatori変異ホモ接合雄や野生型の雌)では雌型ニューロンだけになる。すなわち、一個一個の細胞のレベルでみると、Fruitlessタンパク質(複合体)は全か無的な性のスイッチとして働いているのである。
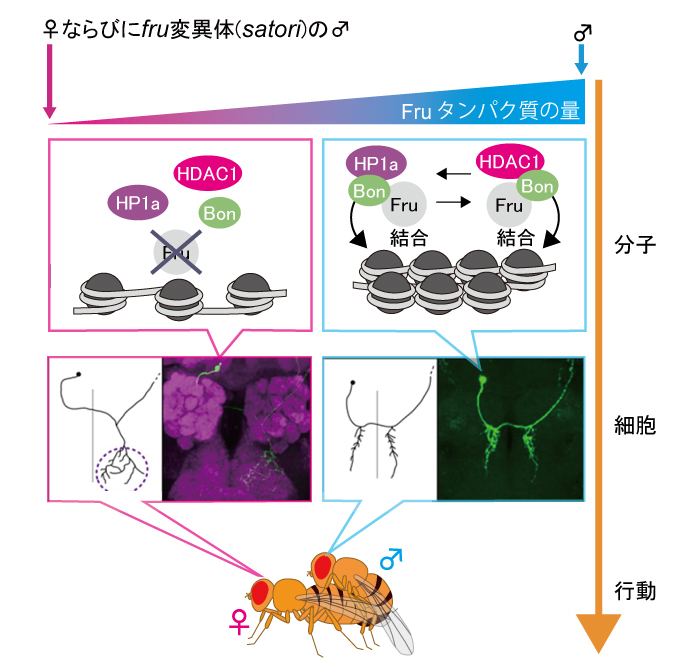
このように、Fruitlessタンパク質は、染色体クロマチン構造の修飾によって多数の標的遺伝子の転写状態をスイッチングすることで、脳の雄―雌を切り替えるブレーカー的働きを担っているといえるだろう。山元研の伊藤によって明らかにされた“エピジェネティクス(epigenetics)による性分化制御”という概念的枠組みは、ほ乳類の脳の性分化にも拡張できる可能性のある大きな発見であり、生物学のトップジャーナルである雑誌Cellに掲載された28)。
さらに2016年には、Fruitlessタンパク質によって直接転写がコントロールされる遺伝子、つまり標的遺伝子の第1号として、神経突起の伸び縮みを制御するrobo1を特定することができた29)。とはいえ、Fruitlessタンパク質が100個に上る遺伝子の転写をオーケストラの指揮者の如く制御して、一気にニューロンを雄の形に改造する“離れ業”の極意は未だ謎であり、この仕組みの具体像の解明は、山元研にとって喫緊の課題となっている。
Proc. Natl. Acad.
Sci. U.S.A. 93, 9687-9692.
Control
of male sexual behavior and sexual orientation in Drosophila by the fruitless gene.
Cell 87,
1079-1089.
Cell 149,
1327-1338.
Curr. Biol. 26, 1532-1542.
Designed by CSS.Design Sample
