研究課題
「細胞間接着・骨格の秩序形成メカニズムの解明と上皮バリア操作技術の開発」
研究期間 2013年10月~2018年3月
研究代表者:月田 早智子(大阪大学 大学院生命機能研究科、教授)
研究分担者:大岩和弘
概要-Outline-/ 目的-Purpose- / 方法-Methods- / 結果-Results-
→数理モデル-Models Numerical-
→まとめ-Summary-
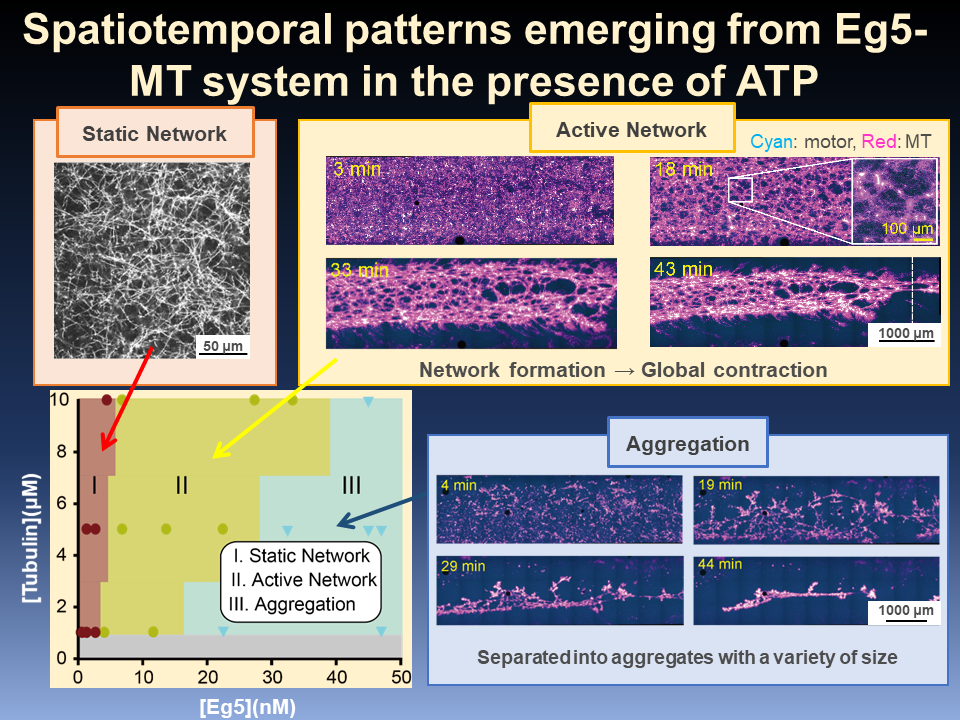
微小管のプラス端に集積して星状体構造を形成するキネシン-5は、その濃度が低い場合には、星状体同士を接続するものの全体構造は変化させません(静的ネットワーク)。しかし、キネシン-5の濃度を上げると、微小管ネットワーク全体はゆっくり縮み始め、やがて、ネットワークの一部が崩壊して急激な収縮を生じます。微小管より200倍も柔軟で、比較的短いフィラメントでできているアクチンフィラメントのネットワークでは、このような収縮はマイクロメートル・スケールで頻繁に観察され報告されてきました。しかし、直線的な構造、星状体のような放射状構造を作る傾向にある微小管での収縮の機構は、そのサイズはアクチンの場合と大きく異なっています。ミリメートルに広がる実験槽の中をくまなく観察することで、微小管ネットワーク全体が収縮することを観察できたのです。この収縮性は、微小管の端をしっかりとつかんでいるタンパク質モータの濃度と力学特性に依存します。モータの特性を変えた場合には、均一で小さな星状体が実験槽全面に分散して形成されることを確認しました。これら観察は、タンパク質フィラメントの収縮性の一般原則を明らかにする上で、新たな知見を与えたものと考えられます。また、キネシン-5によるネットワーク全体の収縮は、紡錘体の挙動を理解する上でも重要です。なぜならば、このキネシンは、細胞分裂における紡錘体の形成や伸長に働くとされているからです。今回観察された収縮は、紡錘体形成や紡錘体伸長で生じている現象を再現している可能性があります。



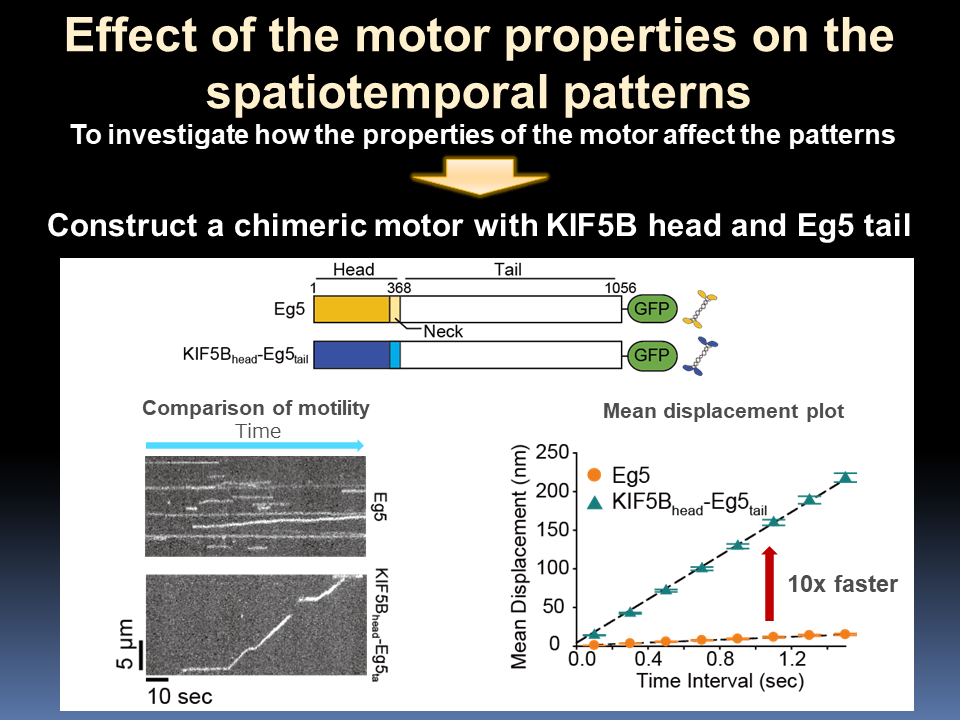
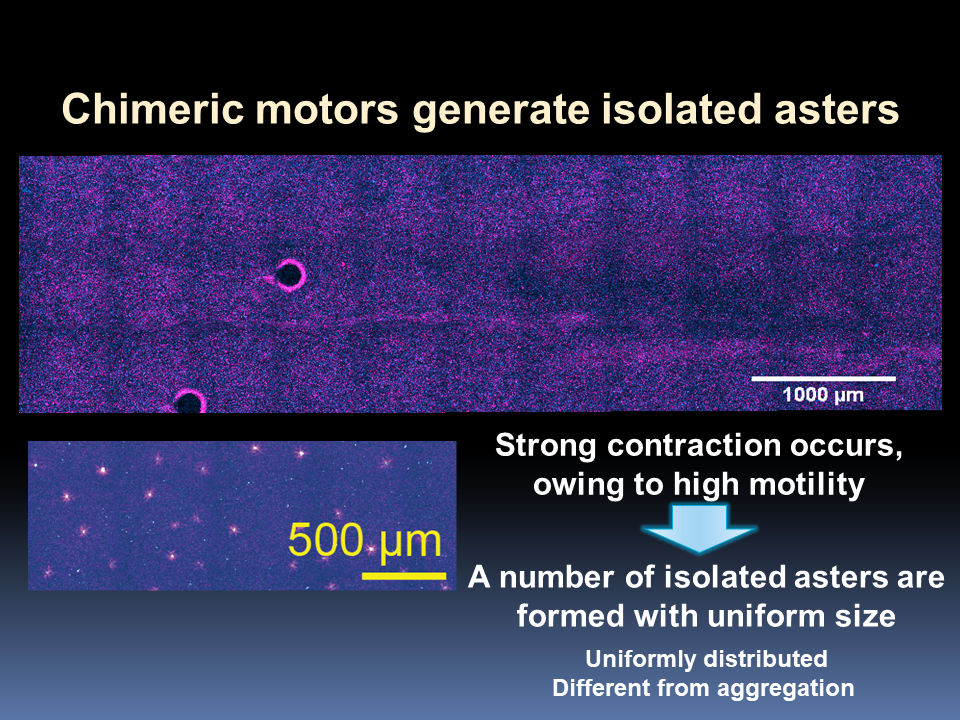
→数理モデル-Models Numerical-
→まとめ-Summary-
