研究課題
「細胞間接着・骨格の秩序形成メカニズムの解明と上皮バリア操作技術の開発」
研究期間 2013年10月~2018年3月
研究代表者:月田 早智子(大阪大学 大学院生命機能研究科、教授)
研究分担者:大岩和弘
概要-Outline-/ 目的-Purpose- / 方法-Methods- / 結果-Results-
→数理モデル-Models Numerical-
→まとめ-Summary-
細胞骨格繊維とその結合タンパク質(モータも含む)の相互作用によって、様々な形態が自己組織的に創出する現象は、近年世界中の様々な研究室から報告されるようになってきている。これは、細胞内の複雑な現象を、その要素に分けてから再構築することで、現象の必須要素を特定していこうとする研究の流れであり、また、同時に局所相互作用によって大局的な構造が創出する一般原理を理解する流れでもある。本研究プロジェクトで研究が進んだ微小管と微小管結合タンパク質、モータの相互作用が創出する構造の解析は、この研究の流れに先行するものであり、数理モデル化したことで、検証可能な作業仮説を提案できたと考えている。今後、この自己組織化をいかに簡素な形で制御できるかを問う研究に展開していくものと考える。
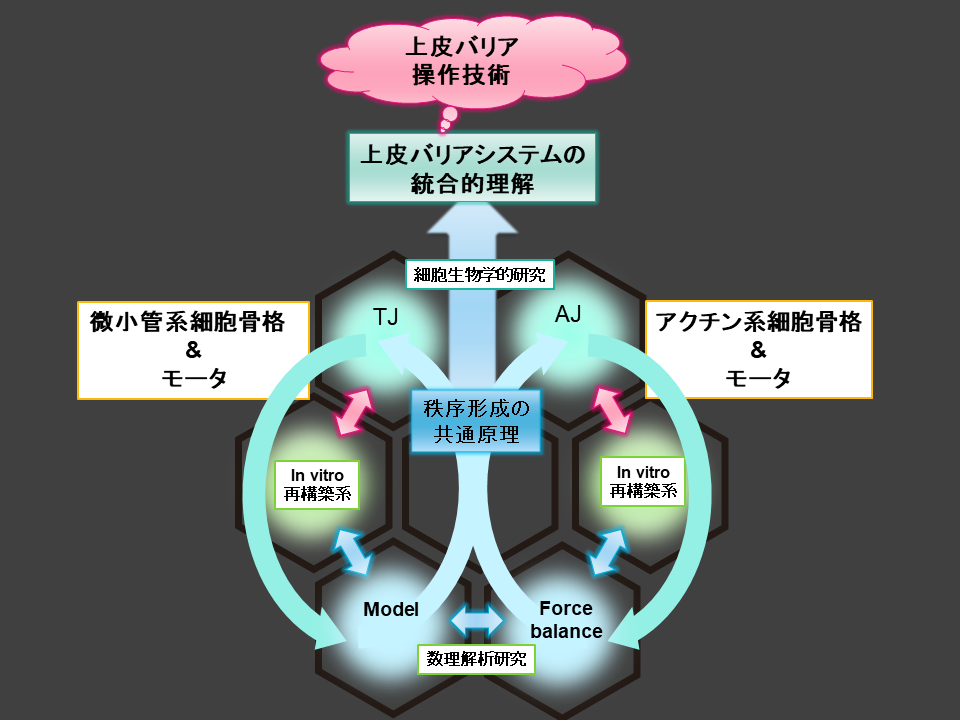
研究成果
再構成系を用いた実験系を用いて、微小管とタンパク質モーターを用いてアピカル微小管ネットワーク形成の試験管内での動的秩序解析を行い、その結果を基にして数理モデルを構築した。これによって、微小管関連タンパク質が持つ、微小管を束化する能力(糊性)と、微小管を滑らせる運動能のバランスによって、様々な形態の微小管ネットワークが生み出されることを明らかにした。 この再構成実験系を拡張し、数理モデルと統合することで、多繊毛上皮細胞の形成過程で転写量が増加する微小管関連タンパク質の微小管ネットワーク形成における役割を明らかにすることができた。
顕著な成果
試験管内再構築系による微小管ネットワーク形成のメカニズムの解明
試験管内再構築技術を用いて、微小管とタンパク質モーターであるキネシンが自己組織的に形成するネットワークの振る舞いを定量的に解析し、その数理モデル化に成功した。微小管とキネシンは細胞の形態形成、細胞分裂や細胞内物質輸送などの重要な生命機能の基盤を担う細胞骨格の主要要素であり、このネットワークの動態観察システムの構築と理論モデルの確立は、生命現象の様々な場面で現れる細胞内秩序構造の形成メカニズムの解明とその秩序構造の操作技術につながることが期待される成果である。
